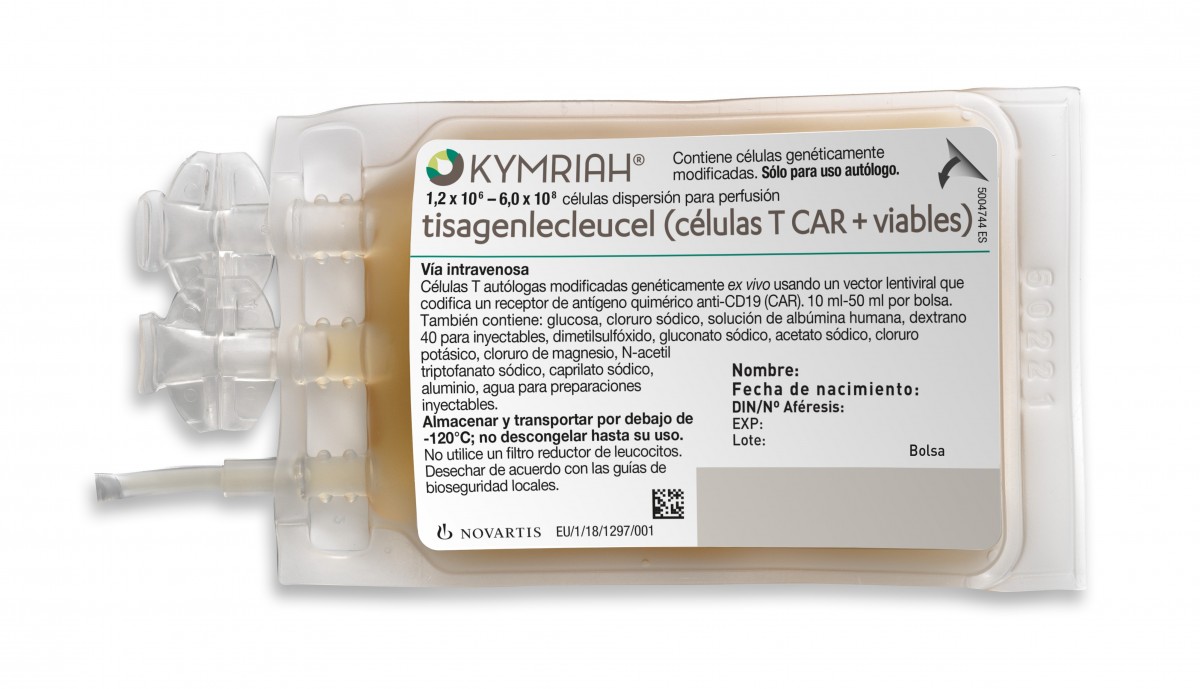
KYMRIAH 1,2 x 10e6 - 6,0 x 10e8 celulas dispersion para perfusion 1-3 bolsas de perfusión (1 dosis de tratamiento individual).
Laboratorio titular: NOVARTIS EUROPHARM LIMITED.
Laboratorio comercializador: NOVARTIS FARMACEUTICA S.A..
Sistema de clasificación Anatómico, Terapéutica, Química (ATC) del medicamento: Grupo Anatómico principal: AGENTES ANTINEOPLÁSICOS E INMUNOMODULADORES. Grupo Terapéutico principal: AGENTES ANTINEOPLÁSICOS. Subgrupo Terapéutico Farmacológico: OTROS AGENTES ANTINEOPLÁSICOS. Subgrupo Químico-Terapéutico Farmacológico: Terapia génica y celular antineoplásica. Sustancia final: tisagenlecleucel .
Indicaciones:
Este medicamento está sujeto a prescripción médica, sí afecta a la conducción, no es un medicamento genérico, es de uso hospitalario, la dosificación es 1,2 x 10e6 - 6,0 x 10e8 celulas dispersion para perfusion y el contenido son 1-3 bolsas de perfusión (1 dosis de tratamiento individual).
▼ El medicamento 'KYMRIAH 1,2 x 10e6 - 6,0 x 10e8 celulas dispersion para perfusion' está sujeto a seguimiento adicional y por tanto lleva triángulo negro, según la Directiva 2010/84/UE y el Reglamento 1235/2010 del Parlamento Europeo y del Consejo.
Está considerado un medicamento "huérfano" según el Reglamento (CE) n° 141/2000 del Parlamento Europeo y del Consejo del 16 de diciembre de 1999.
Vías de administración:
- VÍA INTRAVENOSA.
Composición (1 principios activos):
- 1.- TISAGENLECLEUCEL. Principio activo: 1,2 x 10e6 - 6 x 10e8 células. Composición: 1 bolsa perfusión. Administración: 1 bolsa perfusión. Prescripción: 1,2 x 10e6 - 6 x 10e8 células.
Prospecto y ficha técnica:
Prospecto y ficha técnica en el Centro de Información online de Medicamentos de la AEMPS - CIMA.
Comercialización:
SÍ se comercializa.
Fecha de autorización del medicamento: 17 de Septiembre de 2018.
Fecha de comercialización efectiva de la presentación: 12 de Diciembre de 2018.
Situación del registro del medicamento: Autorizado.
Situación del registro de la presentación del medicamento: Autorizado.
Fecha de ultimo cambio de la situación del registro del medicamento: 18 de Septiembre de 2018.
Fecha de la situación de registro de la presentación: 17 de Septiembre de 2018.
8 excipientes:
KYMRIAH 1,2 x 10e6 - 6,0 x 10e8 celulas dispersion para perfusion SÍ contiene 8 excipientes de declaración obligatoria.
- ACETATO SODICO.
- DEXTROSA.
- CLORURO POTASICO.
- CLORURO DE SODIO.
- DIMETILSULFOXIDO.
- GLUCONATO DE SODIO.
- POTASIO.
- SODIO.
Sujeto a 1 notas de seguridad:
- Número: MUH (FV), 03/2024. Referencia: MUH (FV), 03/2024. Fecha: 17/06/2024 0:00:00. La AEMPS informa del riesgo de neoplasias malignas secundarias de células T asociado a terapias CAR-T
Snomed CT:
Descripción clínica de sustancia/s activa/s: tisagenlecleucel.
Descripción clínica del producto: Tisagenlecleucel 1,2 x 10e6 - 6 x 10e8 células inyectable perfusión.
Descripción clínica del producto con formato: Tisagenlecleucel 1,2 x 10e6 - 6 x 10e8 células inyectable perfusión 1 dosis (1 - 3 bolsas).
Origen y fecha de los datos:
Fuente de la información: Agencia Española de Medicamentos y Productos Sanitarios.
Aquí puede consultar la lista de medicamentos que comienzan con la letra K.
Datos del medicamento actualizados el: .
Código Nacional (AEMPS): 723579. Número Definitivo: 1181297001.