GENOTONORM KABIPEN 5,3 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE , 1 vial de doble cámara.
Laboratorio: PFIZER S.L..
Sistema de clasificación Anatómico, Terapéutica, Química (ATC) del medicamento: Grupo Anatómico principal: PREPARADOS HORMONALES SISTÉMICOS, EXCLUYENDO HORMONAS SEXUALES E INSULINAS. Grupo Terapéutico principal: HORMONAS HIPOFISARIAS E HIPOTALÁMICAS Y SUS ANÁLOGOS. Subgrupo Terapéutico Farmacológico: HORMONAS DEL LÓBULO ANTERIOR DE LA HIPÓFISIS Y SUS ANÁLOGOS. Subgrupo Químico-Terapéutico Farmacológico: Somatotropina y agonistas de la somatotropina. Sustancia final: Somatotropina.
Indicaciones:
Este medicamento está sujeto a prescripción médica, no afecta a la conducción, no es un medicamento genérico, es de uso hospitalario, es un fármaco serializado (en su envase figura un dispositivo de seguridad), la dosificación es 5,3 mg y el contenido son 1 vial de doble cámara.
Formatos de presentación:
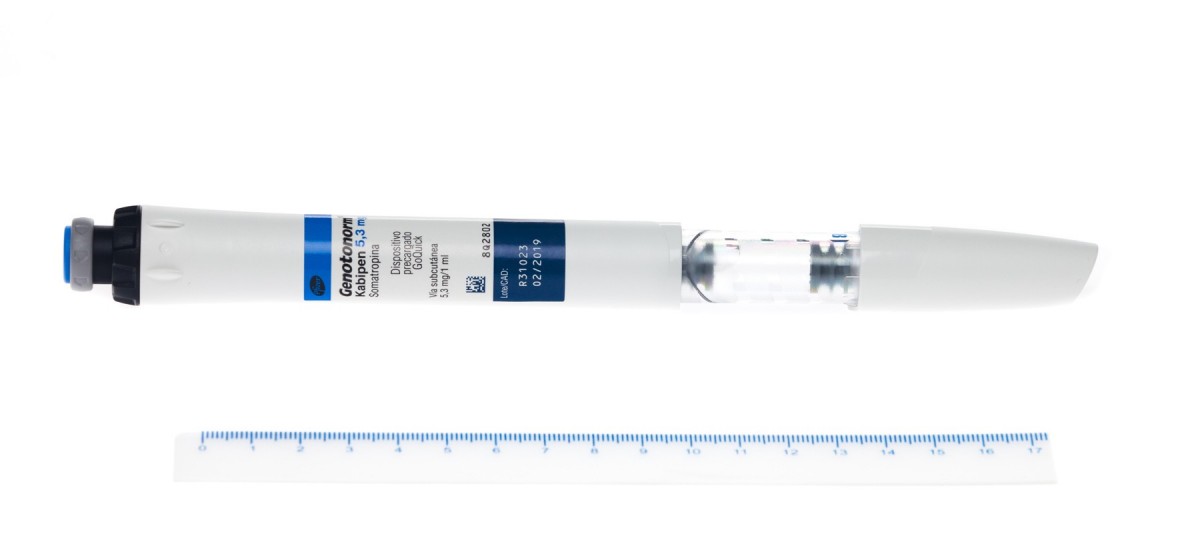
- GENOTONORM KABIPEN 5,3 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE , 1 vial en dispositivo precargado. Comercializado (05 de Abril de 2011). Autorizado.
- GENOTONORM KABIPEN 5,3 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE , 1 vial de doble cámara. No comercializado (01 de Junio de 1992). Autorizado.
Vías de administración:
- VÍA SUBCUTÁNEA.
Composición (1 principios activos):
- 1.- SOMATROPINA. Principio activo: 5.3 mg. Composición: 1 vial para inyección. Administración: 1 vial para inyección. Prescripción: 5.3 mg.
Prospecto y ficha técnica:
Prospecto y ficha técnica en el Centro de Información online de Medicamentos de la AEMPS - CIMA.
Medicamentos con el mismo principio activo y misma vía de administración:
- GENOTONORM KABIPEN 5,3 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE , 1 vial en dispositivo precargado.
Comercialización:
NO se comercializa.
Fecha de autorización del medicamento: 01 de Junio de 1992.
Fecha de comercialización efectiva de la presentación: 28 de Octubre de 2015.
Situación del registro del medicamento: Autorizado.
Situación del registro de la presentación del medicamento: Autorizado.
Fecha de ultimo cambio de la situación del registro del medicamento: 01 de Junio de 1992.
Fecha de la situación de registro de la presentación: 01 de Junio de 1992.
3 excipientes:
GENOTONORM KABIPEN 5,3 mg POLVO Y DISOLVENTE PARA SOLUCION INYECTABLE SÍ contiene 3 excipientes de declaración obligatoria.
Snomed CT:
Descripción clínica de sustancia/s activa/s: somatropina.
Descripción clínica del producto: Somatropina 5,3 mg inyectable.
Descripción clínica del producto con formato: Somatropina 5,3 mg inyectable 1 vial.
Origen y fecha de los datos:
Fuente de la información: Agencia Española de Medicamentos y Productos Sanitarios.
Aquí puede consultar la lista de fármacos que empiezan por la G.
Datos del medicamento actualizados el: .
Código Nacional (AEMPS): 988998. Número Definitivo: 59427.