ESTALIS SEQUIDOT PARCHE TRANSDERMICO , 8 parches.
Precio ESTALIS SEQUIDOT PARCHE TRANSDERMICO , 8 parches: PVP 11.58 Euros. con aportación especial (22 de Noviembre de 2024).
El estado actual del medicamento en el nomenclátor de facturación es 'SUSPENSION TEMPORAL GENERAL' con fecha de alta 05/08/2008.
Laboratorio: BEXAL FARMACEUTICA S.A..
Sistema de clasificación Anatómico, Terapéutica, Química (ATC) del medicamento: Grupo Anatómico principal: SISTEMA GENITOURINARIO Y HORMONAS SEXUALES. Grupo Terapéutico principal: HORMONAS SEXUALES Y MODULADORES DEL SISTEMA GENITAL. Subgrupo Terapéutico Farmacológico: PROGESTÁGENOS Y ESTRÓGENOS EN COMBINACIÓN. Subgrupo Químico-Terapéutico Farmacológico: Progestágenos y estrógenos, preparados secuenciales. Sustancia final: Noretisterona y estrógeno.
Indicaciones:
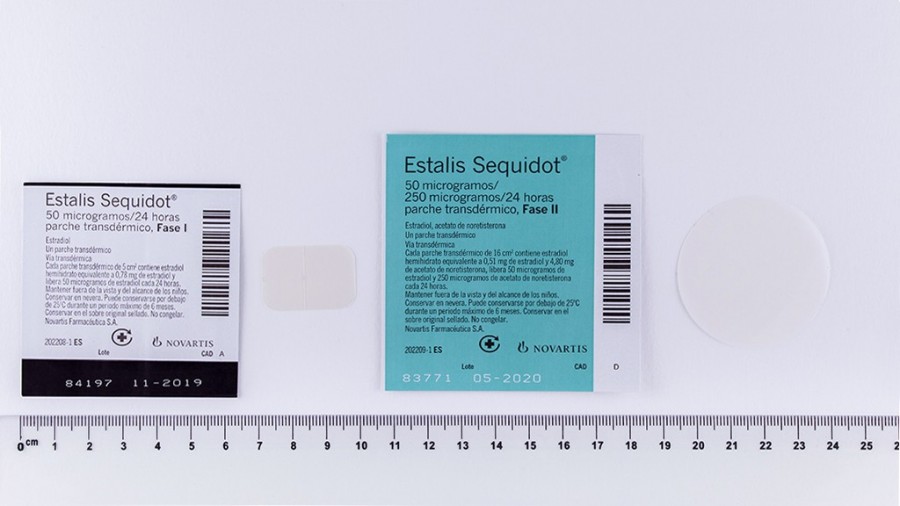
Este medicamento está sujeto a prescripción médica, no afecta a la conducción, no es un medicamento genérico, es un medicamento sustituible, es para un tratamiento de larga duración (TLD), es un fármaco serializado (en su envase figura un dispositivo de seguridad) y la fecha de caducidad del último lote liberado sin serialización es 30/11/2020, la dosificación es (0/50 microgramos/24 h) + (250/50 microgramos/24 h) y el contenido son 8 parches.
Vías de administración:
- VÍA TRANSDÉRMICA.
Composición (3 principios activos):
- 1.- NORETISTERONA ACETATO. Principio activo: 250 microgramos/24 h. Composición: 1 parche. Administración: 1 parche. Prescripción: (0,78/0) + (0,51 + 4,8) (mg/mg) + (mg/mg).
- 1.- NORETISTERONA ACETATO. Composición: 1 parche. Administración: 1 parche. Prescripción: (0,78/0) + (0,51 + 4,8) (mg/mg) + (mg/mg).
- 2.- ESTRADIOL HEMIHIDRATO. Principio activo: 50 microgramos/24 h. Composición: 1 parche. Administración: 1 parche. Prescripción: (0,78/0) + (0,51 + 4,8) (mg/mg) + (mg/mg).
Prospecto y ficha técnica:
Prospecto y ficha técnica en el Centro de Información online de Medicamentos de la AEMPS - CIMA.
Comercialización:
NO se comercializa.
Fecha de autorización del medicamento: 18 de Abril de 2008.
Fecha de comercialización efectiva de la presentación: 06 de Octubre de 2011.
Situación del registro del medicamento: Suspenso.
Situación del registro de la presentación del medicamento: Suspenso.
Fecha de ultimo cambio de la situación del registro del medicamento: 24 de Junio de 2024.
Fecha de la situación de registro de la presentación: 24 de Junio de 2024.
Interacciones medicamentosas:
Ulipristal. Descripción: ulipristal. Efecto: Reducción de la eficacia de ulipristal. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Ulipristal. Descripción: ulipristal. Efecto: Reducción de la eficacia de ulipristal. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Rifampicina. Descripción: rifampicina. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Rifabutina. Descripción: rifabutina. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Descripción: Barbitúricos y derivados. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Descripción: Derivados de la hidantoína. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Carbamazepina. Descripción: carbamazepina. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Oxcarbazepina. Descripción: oxcarbazepina. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Topiramato. Descripción: Neurolépticos que producen Torsades de Pointes. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
Perampanel. Descripción: perampanel. Efecto: Disminución del efecto anticonceptivo. Recomendación: Asociación desaconsejada. Valorar el beneficio/riesgo del tratamiento.
1 excipientes:
ESTALIS SEQUIDOT PARCHE TRANSDERMICO SÍ contiene 1 excipientes de declaración obligatoria.
Problemas de suministro:
- Fecha prevista de inicio 07/07/2022. El médico prescriptor deberá determinar la posibilidad de utilizar otros tratamientos comercializados.
Snomed CT:
Descripción clínica de sustancia/s activa/s: noretisterona + estradiol.
Descripción clínica del producto: Noretisterona/Estradiol (0/50 microgramos/24 h) + (250/50 microgramos/24 h) parche transdérmico.
Descripción clínica del producto con formato: Noretisterona/Estradiol (0/50 microgramos/24 h) + (250/50 microgramos/24 h) 8 parches transdérmicos.
Origen y fecha de los datos:
Fuente de la información: Agencia Española de Medicamentos y Productos Sanitarios.
Aquí puede consultar la lista de fármacos que comienzan con la letra E.
Datos del medicamento actualizados el: .
Código Nacional (AEMPS): 660867. Número Definitivo: 69746.